- Excitation lumineuse à bande de longueur d'onde étroite (LED)
- Mesure de luminosité directe : photomètre (possibilité d'inserer filtre)
- Mesure de luminosité à 45° : fluorimètre (possibilité d'insérer un filtre)
- Contrôlé par microprocesseur :
- Protocoles intégrés : Bradford, [ADN], ...
- Etalon semi-automatique
Cette étude va vous permettre de concevoir un photomètre / fluorimètre : c'est un appareil qui mesure une quantité de lumière. En biologie il pourra être utilisé pour toute une gamme de mesure de photométrie pour, par exemple, estimer la concentration en protéine d'un echantillon (voir protocole Bradford dans la section Biologie). On pourra aussi l'utiliser pour mesurer la fluoréscence émise par le bromure d'ethidium pour estimer la concentration en ADN d'une solution. Bien que la précision de cet instrument n'atteigne pas celles des versions commerciales, il rendra que grand service à un biologiste amateur.
Les différents aspects utiles pour cette réalisation sont :
- Mesure de luminosité par capteur à photodiode intégré (et conditionné)
- Utilisation d'un convertisseur A/D intégré dans un microcontroleur
- Utilisation d'un microcontroleur de type PIC
- Mis en œuvre d'un afficheur LCD (via le microcontroleur)
- Un tout peutit peu (le minimum...) de mecanique pour la partie optique
La spectrométrie permet d'étudier la matière en observant les changements de propriété d'une onde électromagnétique (ici la lumière visible ou UV) lorsque elle interagie avec cette matière [1]. Une onde électromagnétique est caractérisée par son énergie, sa fréquence, sa longueur d'onde (wavelength) et son intensité mais ces caractéristiques sont interdépendantes et peuvent être décrites (selon la mécanique quantique) en terme de d'onde (phénomène ondulatoire) ou en terme de particule (les photons).
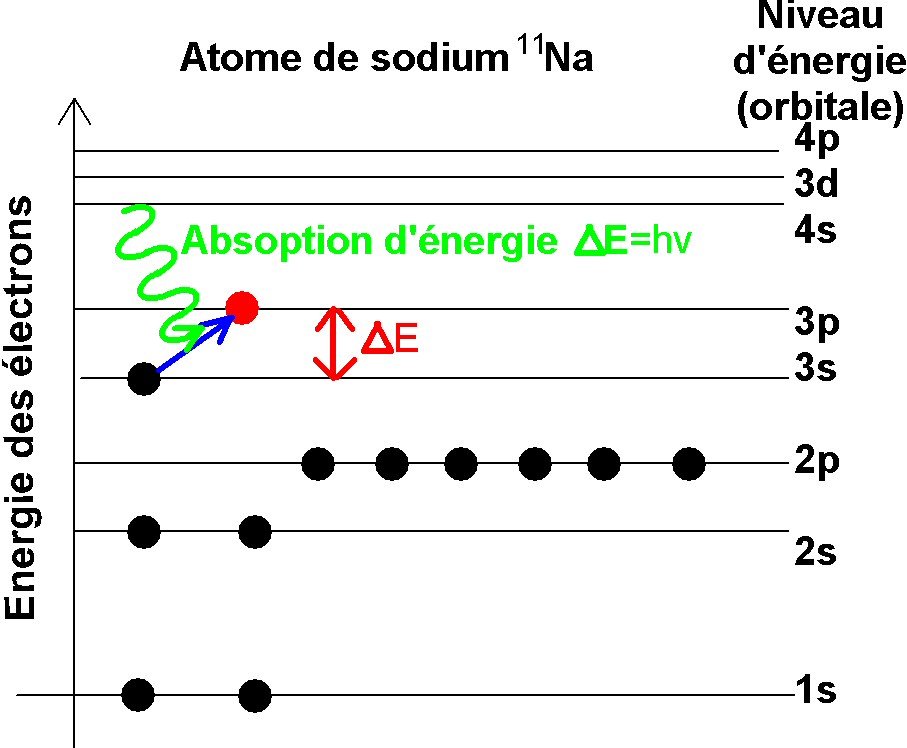
Les électrons qui composent les atomes ou les molécules ne peuvent êtres distribués que sur des niveaux d'énergie discrets. Par exemple pour l'atome de sodium (Na) les électrons sont distribués selon la figure1. qui correspond à l'état fondamental de l'atome. Ces électrons ne peuvent changer de niveau d'énergie qu'en sautant d'un niveau donné à un autre : pour augmenter de niveau le système doit recevoir de l'énergie ce qui se traduit par un spectre d'absoption si l'énergie est fournie par une onde électromagnétique. Par contre lorsque qu'un électron passe d'un niveau énergétique haut vers un niveau énergétique plus faible le sytème émet de l'énergie c qui se traduit par un spectre d'emission.
figure
1.- Niveau d'énergie des électrons de l'atome de sodium 11Na
et changement du niveau d'énergie d'un
électron lorsque on apporte
une quantité d'énergie ΔE correspondant à une
onde de fréquence v
La variation dénergie d'un électron lorsque il change de niveau est donnée par la relation :

 est la variation d'énergie émise lorsque l'électron descend de niveau
ou absorbée lorsque l'électron augmente de niveau.
est la variation d'énergie émise lorsque l'électron descend de niveau
ou absorbée lorsque l'électron augmente de niveau.  est létat énergétique initial de l'électron,
est létat énergétique initial de l'électron,  est l'état énergétique final de l'électron,
est l'état énergétique final de l'électron, 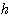 est la constante de Planck (=
est la constante de Planck (=  ),
), 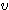 est la fréquence de l'onde électromagnétique en Hertz. Avec
est la fréquence de l'onde électromagnétique en Hertz. Avec 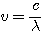 où c est la vitesse de la lumière(
où c est la vitesse de la lumière( ) et
) et  est la longueur d'onde le l'onde électromagnétique (en sous multiples du
m : cm, µm, nm ). Cette équation met en
écidence qu'à une quantité d'énergie
donnée correspond une onde d'une longueur d'onde donnée
(fig. 2)
est la longueur d'onde le l'onde électromagnétique (en sous multiples du
m : cm, µm, nm ). Cette équation met en
écidence qu'à une quantité d'énergie
donnée correspond une onde d'une longueur d'onde donnée
(fig. 2)
Nous pouvons interpréter cette
propriété par : en apportant de l'énergie à un atome, sous la forme
d'une onde lumineuse, si cette quantité d'énergie correspond à 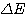 cette
énergie absorbée créra une bande d'absorbance dans l'onde excitatrice
pour la longueur d'onde
cette
énergie absorbée créra une bande d'absorbance dans l'onde excitatrice
pour la longueur d'onde  correspondant à ΔE.
correspondant à ΔE.
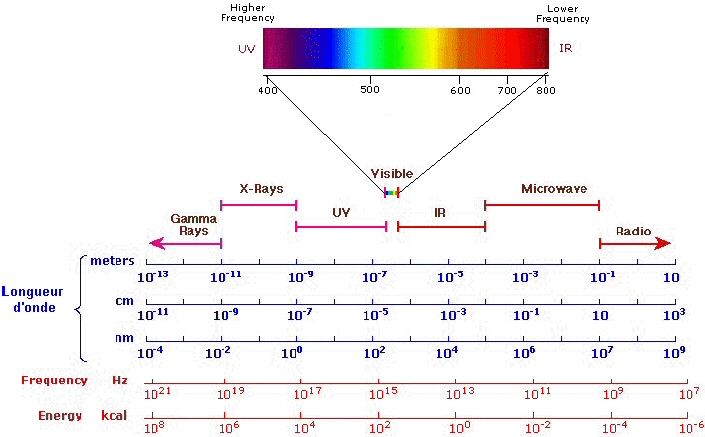
figure
2.- Spectre électromagnétique, longueur d'onde et énergie.
Cette propriétée d'absorbance va nous permettre, par exemple, de déterminer la concentration en atome ou en molécule d'une solution en l'exposant à une onde monochromatique caractéristique de sa structure. Les molécules observées en biologie ont des longueurs d'onde caractéristiques situées habituellement entre 200-1000nm c'est à dire de l'ultraviolet proche en passant par la lumière visible jusqu'à l'infra-rouge proche.
Le photomètre que nous allons étudier met en pratique la théorie vue précedement. Il est constitué sur le schéma très classique [2] des spectrophotomètre à faisceau unique donné en fig3. Seul les composants indispensable sont réalisés donc les performance d'un tel instrument ne seraient être comparé à un instrument du commerce mais il pourra rendre de nombreux service.
figure 3.- Schéma fonctionnel d'un spéctrophotomètre
Sur la fig. 3 le bloc rouge appelé monochromateur est composé d'une source de lumière blanche (polychromatique) d'une optique de focalisation du rayon lumineux (fente +lentilles) et d'un composant disperseur comme un prisme ou un réseau de diffraction qui permet de séparer les différentes longueurs d'ondes constituant la lumière blanche et ainsi de produire par l'utilisation d'une fente de sélection un rayonnement monochromatique. Le déplacement de la fente permet de choisir la longueur d'onde d'excitation de l'échantillon contenu dans la cuve d'analyse. Un détecteur placé en fin de chaîne de traitement mesure le rayonnement transmis. les Instruments modernes possèdent un système à microprocesseur qui permet de commander le monochromateur, d'enregistrer les mesures du détecteur, d'analyser les fluctuations de la source, etc.. et ainsi de balayer et de tracer tout le spectre d'absorption de l'échantillon de l'IR à UV.
Notre
réalisation utilisera comme monochromateur une source monochromatique
constituée par une LED. Ces diodes électroluminescentes
sont constituées d'une jonction semi-conducteur qui produit
un rayonnement casi-monochromatique. Elles existent en différentes
couleurs : IR, rouge, orange, jaune, vert, bleu, UV et produisent
une lumière à spectre très étroit. L'avantage
d'utiliser une LED réside dans sa facilité de mise
en œuvre et son coût très faible, par contre il ne
sera pas possible de balayer un spectre continu mais seulement d'effectuer
des mesures pour les valeurs existantes ce qui est déjà
très utile pour des applications en biologie.
Le détecteur est habituellement constitué d'un tube photomultiplicateur (PMT). L'avantage d'un tél dispositif est sa sensibilité qui permet de détecter de très faibles quantités de lumière par contre sa mise en œuvre est relativement complexe puisque il nécessite des tensions continues de l'ordre de 1000V de plus onéreux, fragile et difficile à se procurer pour un non spécialiste. Nous utiliserons à sa place un dispositif à semi-conducteur constitué d'une photo-diode avec un amplificateur intégré. Bien que la sensibilité d'une photodiode ne soit pas comparable à celle d'un PMT elle sera suffisante pour les application que nous envisageons.
Loi
de Beer-Lambert
Le
photomètre va nous permettre d'expérimenter la loi
de Beer-Lanbert consequence de la théorie vue plus haut en
mesurant l'absorbance de l'echantillon afin d'en déterminer
sa concentration pour une molécule particuliaire. L'intensité
lumineuse diminue exponetiellement losque elle traverse un echantillon
:
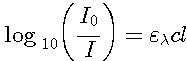
 est appelé coefficient d'extinction pour une longueur d'onde
est appelé coefficient d'extinction pour une longueur d'onde  donnée.
donnée.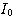 est l'intensité lumineuse de la lumière incidente
est l'intensité lumineuse de la lumière incidente  est l'intensité lumineuse de la lumière transmise (au détecteur)
est l'intensité lumineuse de la lumière transmise (au détecteur) est la concentration de la molécule (à déterminer)
dans l'échantillon
est la concentration de la molécule (à déterminer)
dans l'échantillon est la longueur du chemin parcouru par la lumière (chemin optique)
est la longueur du chemin parcouru par la lumière (chemin optique)
Le terme gauche de l'égalité est souvent symbolisé par D.O (O.D. en anglais) pour densité optique ou Absorbance (parfois exprimé en pourcentage : A x 100)
On peut donc considérer (sous certaines restrictions) que la concentration est proportionelle à l'absorbance. Mais attention : en pratique la mesure de l'absorbance n'est pas directe mais se fait par l'intermédiaire d'un colorant qui réagi avec la molécule d'interêt. Il faut alors tenir compte des propriétés de ce colorant en particulier de la plage de linéarité de ce dernier qui souvent présente un plateau pour les fortes concentrations.
La
fluorescence
Comme
nous l'avons vu dans la théorie lorsque un atome recois une
certaine quantité d'émergie il peut passer dans un
état excité pendant une courte période. Ensuite
il retourne à l'état fondamental en libèrant
seulement une partie de l'énergie recue sous la forme
d'une onde lumineuse à une longueur d'onde supérieure
de l'onde incidente (moins énergétique) ce phénomène
qui caractérise certaines molécule est appelé
fluorescence.
Les constituants d'un fluorimètre sont
partiquement identiques à celui d'un photomètre aux
différences suivantes
(1) un filtre d'excitation permet
de sélectioner la longueur d'onde de la lumière incidente
(ou un monochromateur)
(2) un filtre d'émission placé
entre l'echantillon et le détecteur permet de mesurer la
fluorescence à une longueur d'onde supérieure à
l'excitation
(3) la fluorescence ne se mesure pas dans l'axe
du faisceau incidant mais à 90°
Nous apporterons donc quelques modifications à notre photomètre de base afin de lui permetre de mesurer une fluorescence dans un cas particulier (avec une seule longueur d'onde d'excitation). Il nous permettra ainsi (voir page biologie) d'estimer la concentration d'un echantillon en ADN. Mettons nous maintenant à la pratique ... cliquez sur réalisation...
[1]
Wilson K, Walker J. Principles and techniques of Practical Biochemistry.
Cambridge univercity press. 2000, ISBN0-521-65873-X
[2]
A. Martin, Introduction au laboratoire de biochimie médicale,
ed. Ellipses, 1995, pp 83-110, ISBN 2-7298-9570-1
[3] J. Fisher,
J.R.P. Arnold, L'essentiel en chimie pour biologistes, Berti Editions,
2001, pp 235-250